
Funciones Químicas
Una función química es un conjunto de compuestos que tienen propiedades muy parecidas en virtud a que sus moléculas contienen uno o más átomos iguales.
Tomando en consideración que según Brandwein (1988), existen más de 50,000 compuestos químicos inorgánicos en los que no interviene el carbono, se ha buscado un sistema para agruparlos de acuerdo con sus propiedades químicas, para darles nombre y reconocerlos.
Siendo estas las mas representativas funciones químicas: función óxido, función anhídrido, función hidróxido, función ácido y función sal.
el grupo de algunas sustancias compuestas que poseen propiedades químicas semejantes, denominadas propiedades funcionales, recibe el nombre de función química. Cuando un determinado compuesto posee características como acidez obasicidad, solubilidad en agua, reactividad de acuerdo con determinada función química, se dice que este pertenece a esta función química. Las funciones químicas son divididas de acuerdo con la división clásica de la química.
Existen cuatro tipos de función inorgánica: óxido, ácido, base y sal. El criterio de clasificación de una sustancia en una de esas funciones es el tipo de iones que se forman cuando ella es disuelta en agua.
En función de la naturaleza inexistente de los compuestos químicos, las funciones pueden primariamente ser divididas entre funciones inorgánicas que son las funciones de compuestos que no poseen cadena carbonada, que es la principal característica de esos compuestos. Están divididas en ácidos, bases, sales y óxidos y funciones orgánicas que son las relativas a los compuestos orgánicos.

Óxidos
Cuando se hace reaccionar un metal con el oxígeno, se obtiene un óxido:
metal + oxigeno ———› óxido metálico
Na + ———›
sodio + oxigeno ———› óxido de sodio
Nomenclatura
Para formar el nombre del óxido se escribe la palabra "óxido" seguido de la preposición "de" y después el nombre del metal. Si el metal presenta más de dos valencias, se escribe entre paréntesis con número romano la valencia del metal con la que esté actuando.
metal + oxigeno ———› óxido metálico
Na + ———›
sodio + oxigeno ———› óxido de sodio
Nomenclatura
Para formar el nombre del óxido se escribe la palabra "óxido" seguido de la preposición "de" y después el nombre del metal. Si el metal presenta más de dos valencias, se escribe entre paréntesis con número romano la valencia del metal con la que esté actuando.
Los Óxidos son compuestos binarios en que el elemento oxígeno presenta número de oxidación igual a -2 y es el más electronegativo de la fórmula volviéndolo al elemento más potente.
[editar]Clasificación de los óxidos
| clasificación | formadores | ejemplos |
|---|---|---|
| básicos | metales con nox +1 o +2 y del grupo 1A e 2A | CaO, FeO, K2O |
| ácidos o anídridos | metales con nox +5, +6 e +7 y ametais con cualquier nox, excepto C+2, N+1y N+2 | SO3, Cl2O, Mn2O7 |
| neutros | C+2, N+1 e N+2 | NO, CO, N2O |
| anfóteros | Los más comunes están formados por los metales RaI, Da, BuN, Da, BrA, BReMBA | Al2O3, MnO2, ZnO, PbO, SnO |
| salinos, mixtos o dobles | metales con nox medio +8/3 | Pb3O4, Fe3O3 |
Obs: los óxidos anfóteros se comportan como óxidos básicos en presencia de ácidos y como óxidos ácidos en presencia de bases.
Obs2: los óxidos mixtos son la "suma" de los óxidos formados por un elemento, o sea, es una nuve con todos los tipos de óxidos de ese elemento:
- FeO + Fe2O3 → Fe3O4
- Casi todos los elementos forman combinaciones estables con oxígeno y muchos en varios estados de oxidación. Debido a esta gran variedad las propiedades son muy diversas y las características del enlace varían desde el típico sólido iónico hasta los enlaces covalentes. Por ejemplo son óxidos el óxido nítrico, NO, o el dióxido de nitrógeno, NO2. Los óxidos son muy comunes y variados en la corteza terrestre. También son llamados anhídridos porque son compuestos que han perdido una molécula de agua dentro de sus moléculas. Por ejemplo el anhídrido carbónico:
CO2
H2CO3. Nomenclatura de los óxidos
a) para cualquier óxido- prefijo + óxido de + prefijo + elemento
Ejemplos: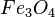 = tetróxido de triferro o tetróxido de hierro (3)
= tetróxido de triferro o tetróxido de hierro (3)
 = trióxido de dinitrogénio o trióxido de nitrógeno (2)
= trióxido de dinitrogénio o trióxido de nitrógeno (2)
b) para elementos con nox fijo- óxido de + elemento
Ejemplos: - óxido de sodio
- óxido de sodio
 - óxido de aluminio
- óxido de aluminio
c) para elementos que no presentan nox fijo- óxido + elemento + sufijo U óxido de + elemento + nox en algarismo romano
Ejemplos: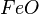 = óxido ferroso u óxido de hierro II
= óxido ferroso u óxido de hierro II
 = óxido férrico u óxido de hierro III
= óxido férrico u óxido de hierro III
d) para óxidos ácidos (o anidridos) apenas- anhídrido + prefijo + elemento + sufijo
nox prefijo sufijo +1 o +2 hipo oso +3 o +4 - oso +5 o +6 - ico +7 (hi)per ico Ejemplos: = anhídrido carbónico
= anhídrido carbónico
 = anhídrido permangánico
= anhídrido permangánico
[editar]Nomenclatura de los peróxidos
- peróxido de + elemento
Ejemplos: = peróxido de hidrógeno
= peróxido de hidrógeno
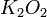 = peróxido de potasio
= peróxido de potasio
[editar]Nomenclatura de los superóxidos
- superóxido de + elemento
Ejemplo: = superóxido de sodio
= superóxido de sodioHidróxido
- Esto se obtiene cuando se combina un óxido con agua.
óxido + agua ———› hidróxido
Se llama radical al grupo de 2 o más átomos que funcionan con una sola valencia.
Nomenclatura
Para nombrarlos, se escribe la palabra "hidróxido" la preposición "de" y el nombre del metal. Si el metal tiene varias valencias, se escribe entre paréntesis con número romano la valencia con que actuó dicho metal.
Ejemplo: el plomo tiene dos valencias por lo que se tiene:
En forma simplificada se pueden formar los hidróxidos combinando
directamente el metal con el radical (OH)-1
se cruzan las valencias.
Ácidos
- Según Arrhenius, ácido es toda la sustancia que libera un ion H+ en agua, o, más detalladamente sustancias que en medio acuoso se disocian, liberando el catión
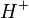 es un anión diferente de
es un anión diferente de  . La teoría actual de Brønsted-Lowry define como ácido una sustancia capaz de recibir un par de electrones. Además, la teoría de Arrhenius también fue actualizada:
. La teoría actual de Brønsted-Lowry define como ácido una sustancia capaz de recibir un par de electrones. Además, la teoría de Arrhenius también fue actualizada:- ácido es toda sustancia que libera un ion H3O+
Clasificación de los ácidosa) de acuerdo con la presencia de oxígeno- Hidrácidos: no poseen oxígeno en la fórmula.
- Ejemplos: HI, HCl, HF.
- Oxiácidos: poseen oxígeno en la fórmula.
- Ejemplos: H2CO3, H2SO3, H2SO4, HNO2.
b) de acuerdo con el grado de disociación iónicaObs: el cálculo de α en los ácidos es igual al desenvuelto en las bases.- α (en porcentaje) = 100 x número de moléculas disociadas/número total de moléculas disueltas
-
- α > 50% → fuerte
- α < 5% → débil
- Hidrácidos:
- Fuertes: HCl < HBr < HI
- Medios: HF (puede ser considerado débil)
- Débiles: los demás
- Oxiácidos:
- Fuertes: si x > 1 (H2SO4)
- Médios: si x = 1 (HClO2)
- Débiles: si x < 1 (HClO)
- x = número de oxígeno - número de hidrógeno
[editar]Nomenclatura de los ácidos
a) Hidrácidos- ácido + elemento + hídrico
Ejemplos: = ácido yodhídrico
= ácido yodhídrico
 = ácido clorhídrico
= ácido clorhídrico
 = ácido sulfhídrico
= ácido sulfhídrico
b) OxiácidosComo pueden ser obtenidos a través de la hidratación de los óxidos ácidos, hay la misma sistemática de nomenclatura.- ácido + prefijo + elemento + sufijo
nox prefijo sufijo +1 o +2 hipo oso +3 o +4 - oso +5 o +6 - ico +7 (hi)per ico Obs: cuanto menos oxígeno, menor es el nox del elemento central y cuanto más oxígeno, mayor es el nox del mismo, como muestran los ejemplos abajo.Ejemplos: = ácido hipocloroso (nox Cl = +1)
= ácido hipocloroso (nox Cl = +1)
 = ácido cloroso (nox Cl = +3)
= ácido cloroso (nox Cl = +3)
 = ácido clórico (nox Cl = +5)
= ácido clórico (nox Cl = +5)
 = ácido perclórico (nox Cl = +7)
= ácido perclórico (nox Cl = +7)Sales
Las sales son compuestos que en medio acuoso se disocian, liberando por lo menos un catión diferente de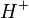 y por lo menos un anión diferente de
y por lo menos un anión diferente de  . Son definidos, muy limitadamente, como compuestos binarios resultantes de la reacción de un ácido y una base.Obs: Cuando están disueltos en agua, sus iones disociados adquieren movilidad y se vuelven conductores de electricidad.
. Son definidos, muy limitadamente, como compuestos binarios resultantes de la reacción de un ácido y una base.Obs: Cuando están disueltos en agua, sus iones disociados adquieren movilidad y se vuelven conductores de electricidad.[editar]Clasificación de las sales
a) de acuerdo con la presencia de oxígeno- Sales haloides: no poseen oxígeno
- Ejemplos:
 ,
, 
- Ejemplos:
- Oxisales: poseen oxígeno
- Ejemplos:
 ,
, 
- Ejemplos:
b) de acuerdo con la presencia de H+ u OH-- Sal normal: está formado por la neutralización completa entre un ácido y una base. No posee ni H+ ni OH-
- Ejemplo:

- Ejemplo:
- Hidrogenosal o hidroxisal: está formado en una reacción de neutralización cuando el ácido y la base no están en proporción estequiométrica. Siendo así, hay una neutralización parcial, sobrando H+ u OH-
- Ejemplo (hidrogenosal):

- Ejemplo (hidroxisal):
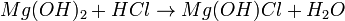
- Ejemplo (hidrogenosal):
- Sal mixta: la sal presenta en su fórmula más de un catión o más de un anión diferentes. Está formado a partir da neutralización de un ácido por más de una base o de una base por más de un ácido.
- Ejemplo:

- Ejemplo:
[editar]Nomenclatura de las sales
a) para sales haloides- ametal + uro de catión
Ejemplo: = cloruro de sodio
= cloruro de sodio
b) para oxisalesUsamos una extensión de la tabla de óxidos ácidos y oxiácidos, pues la nomenclatura de los oxisales también depende del nox.- - óxidos ácidos y
oxiácidosoxisales nox prefijo sufijo sufijo +1 o +2 hipo oso ito +3 o +4 - oso ito +5 o +6 - ico ato +7 (hi)per ico ato Excepciones: Como los elementos B+3, C+4 y Si+4 solo poseen sufijo "ico" en la forma de ácido, cuando son sales, se usa siempre el sufijo "ato".Ejemplos: (nox N = +3) = nitrito de potasio
(nox N = +3) = nitrito de potasio
 (nox Cl = +1) = hipoclorito de sodio
(nox Cl = +1) = hipoclorito de sodio
 (nox Mn = +7) = permanganato de potasio
(nox Mn = +7) = permanganato de potasio
Obs: cuando en la fórmula del sal hay un hidrógeno, agregamos el prefijo "bi" al nombre del catión. = bicarbonato de sodio
= bicarbonato de sodio
- Sales haloides: no poseen oxígeno
-
Para dar nombre a los oxisales se deben considerar las indicaciones de la tabla que se presenta en la siguiente tabla:
Esta tabla está relacionada con la que se encuentra en la función anhídrido. Por lo tanto si el ácido como en este caso no lleva prefijo y su terminación es "ico", se cambia por la terminación "ato" y el nombre de la oxisal del primer ejemplo es sulfato de magnesio
En el caso de las sales haloideas se escribe el nombre del no metal con la terminación "uro" después de la preposición "de" y al final el nombre del metal, llamándose en el caso del segundo ejemplo cloruro de sodio (NaCl).créditos:http://funquimicas.blogspot.com/http://clasesdecimorjl-gmmmc.blogspot.com/2012/08/funciones-quimicas.htmlhttp://www.google.com.co/search?hl=es&site=imghp&tbm=isch&source=hp&biw=1024&bih=475&q=funciones+quimicas&oq=funciones+quimi&gs_l=img.3.1.0l10.67324.74522.0.76145.15.8.0.7.7.0.594.2645.0j2j2j2j1j1.8.0...0.0...1ac.1.11.img.wV6fAlbl6Pk#hl=es&site=imghp&tbm=isch&sa=1&q=funciones+quimicas+&oq=funciones+quimicas+&gs_l=img.3..0i24l5.65976.68209.8.69183.11.10.0.1.1.1.270.1455.2j6j2.10.0...0.0...1c.1.11.img.dqVlZkfWvcQ&bav=on.2,or.r_qf.&bvm=bv.45645796,d.dmQ&fp=77d48677bc5f87cc&biw=1024&bih=475&imgrc=DtWKfraP2eDqxM%3A%3Bx3GfY948fAf7KM%3Bhttp%253A%252F%252F3.bp.blogspot.com%252F-J_f6lCF4V3o%252FUD_-QxMHnYI%252FAAAAAAAAAIA%252FpcyGz9JlK7g%252Fs1600%252Fcnmt_quimica.png%3Bhttp%253A%252F%252Fclasesdecimorjl-gmmmc.blogspot.com%252F2012%252F08%252Ffunciones-quimicas.html%3B321%3B323http://www.salonhogar.net/Quimica/Nomenclatura_quimica/indice.htmRealizado Por:Daniela Fernanda Saenz v.Brayan Gualdron.


